티스토리 뷰

화학을 공부하는 혹은 화학을 어떤식으로든 접하고 있는 사람이라면
몰농도의 개념은 필수라고 할 수 있을 만큼 중요한 개념입니다.
그럼 오늘은 몰농도 공식, 몰농도 계산 그리고 몰농도 시약 제조 방법에 대해
아주 이해하기 쉽게 풀어보겠습니다.
몰농도 공식, 몰농도란?
몰농도는 용액 1L의 부피속에 들어있는 용질의 몰(mol)수로 정의가 됩니다.
기호로는 M(대문자 엠)이 사용되며
1M 의 의미는 용액 1L에 1mol의 용질이 들어있다는 것을 의미합니다.
그럼 이 내용을 바탕으로 몰농도를 공식화 해보면 아래와 같이 나타낼 수 있습니다.
몰농도 = 용질의 mol수 / 1L 용액
참으로 쉽죠?
몰농도 계산
위에서 말씀드린대로 몰농도가 '용액 1L에 포함된 용질의 몰수' 라는 것만 기억하고 있으면
이제부터 몰농도를 계산할 수 있습니다.
2개의 예제를 가지고 계산을 해보도록 하겠습니다.
예제1)
예를들어 내 앞에 염화나트륨(NaCl) 용액이 있는데
용액의 부피는 500mL 였고 1몰의 NaCl이 녹아 있다고 한다면
내 앞에 있는 NaCl 용액의 몰농도는 얼마가 될까요?
==> 우리는 몰농도이 정의를 통해 아주 간단히
염화나트륨(NaCl) 용액의 몰농도를 구할 수 있습니다.
1. 몰농도를 구하기 위해 몰농도의 정의 '용액 1L속에 들어있는 용질의 몰수'를
그대로 대입을 해보면
2. 내 앞에 있는 염화나트륨 용액은 현재 500mL 이고 염화나트륨(NaCl)은
1몰이 녹아있다고 했기 때문에
3. 염화나트륨 용액 1L(=1000mL)속에는 염화나트륨(NaCl)이 2몰 녹아 있게 됩니다.
1몰 NaCl : 500mL = x몰 NaCl : 1000mL
그래서 x = 2몰
4. 즉 염화나트륨 용액 1L속에 용질인 염화나트륨(NaCl)이 2몰이 녹아있기 때문에
몰농도의 정의를 바탕으로 몰농도는 2M이 됩니다.
예제2)
예를들어 A라는 학생이 염화 마그네슘(MgCl2) 용액을 제조했는데
염화마그네슘 5g을 물에 녹여서 용액 100mL 를 만들었다고 가정해보면
A라는 학생이 만든 염화마그네슘(MgCl2) 용액의 몰농도는 얼마가 될까요?
(MgCl2 분자량은 95로 계산한다)
==> 우리는 몰농도의 정의를 통해 염화마그네슘 용액의 몰농도도
아주 간단히 구할 수 있습니다.
1. A학생이 만든 100mL 염화마그네슘 용액에는 5g의 염화마그네슘이 녹아 있습니다.
그럼 1000mL(=1L) 염화마그네슘 용액에는 50g이 녹아있겠지요.
2. 몰농도는 정의에 의하여 용액 1L속에 들어있는 용질의 몰수이기 때문에
용액 1L속에 들어있는 염화마그네슘(용질) 50g을 몰수로만 환산해 주면
우리가 구하고 있는 몰농도가 구해집니다.
3. 문제속에서 염화마그네슘의 분자량은 95로 주어졌기 때문에
염화마그네슘 50g 은 몰수로 환산하면 약 0.526몰(= 50 / 95) 이 됩니다.
1몰: 95 = x몰 : 50
그래서 x = 약 0.526몰
4. 즉 이렇게 하여 우리는 A학생이 만든
염화마그네슘 용액의 몰농도가 0.526M 이라는 것을 구했습니다.
몰농도 시약 제조 방법
그럼 이제 우리는 몰농도를 구하는 방법을 알게되었는데요.
이제 실전으로 실험실에서 실제 특정 몰농도의 시약을 제조하는 방법을 알아보도록 하겠습니다.
예를들어서 1M의 HCl 용액을 만들고자 한다면
우리는 아래의 순서로 용액을 제조하면 됩니다.
1. 먼저 우리는 HCl의 분자량을 알아야 합니다.
여기서는 HCl 분자량을 편의상 36으로 하여 계산해 보겠습니다.
(분자량 계산하는 벙법은 아래 사이트에서 확인 가능합니다.)
2. HCl 분자량 36의 의미는 HCl 1몰의 질량이 36g 이라는 의미를 내포합니다.
3. 몰농도의 정의상 '용액 1L속에 들어있는 용질의 몰수 ' 가 몰농도 이기 때문에
4. HCl 1M을 제조하려면 HCl 1몰의 질량에 해당하는 36g을 플라스크에 넣고
물을 1L(=1000mL)까지 채워주면 1M HCl 제조는 끝이 납니다.
5. 만약에 1M HCl 용액을 500mL만 만들고 싶다면
36g이 아닌 18g의 HCl만 플라스크에 넣고 물을 500mL 까지 채워주면 되지요
1000mL 용액 : 36g HCl = 500mL 용액 : x g HCl
그래서 x = 18g HCl 이 됩니다.
몰농도 시약 제조 계산기
몰농도 시약 제조 시 위에 말씀드린 것처럼 계산하기가 번거롭다면
아래 몰농도 계산기를 통해서 시약 제조 시 용질 몇 g을 넣어야 할지
쉽게 계산하실 수 있습니다.
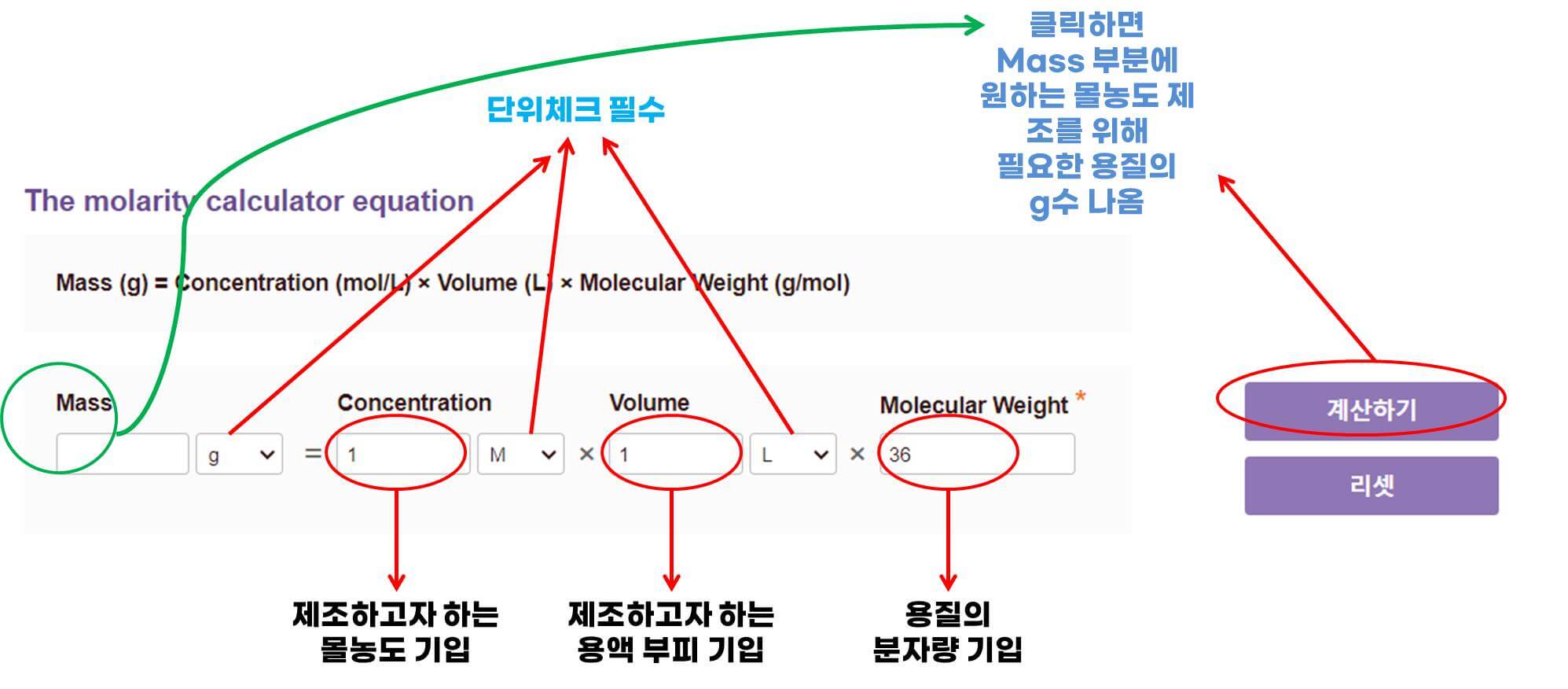
몰농도 계산기 사용절차
1. Concentration에 제조하고자 하는 몰농도를 기입합니다.(단위는 M)
2. Volume에 본인이 제조하고자 하는 부피를 기입합니다.(단위는 L)
3. Molecualr Weight에 용질의 분자량을 기입합니다.
4. 그리고나서 오르쪽에 '계산하기'를 클릭하면
5. 원하는 부피로 원하는 몰농도 제조시 취해야하는 용질의 g수가 계산되어 나옵니다.